11月11日,國家食藥監總局發布國《關于藥品注冊審評審批若干政策的公告》(2015年第230號) ,文件提到要加快8類臨床急需等藥品的審批,其中一類就是兒童用藥。

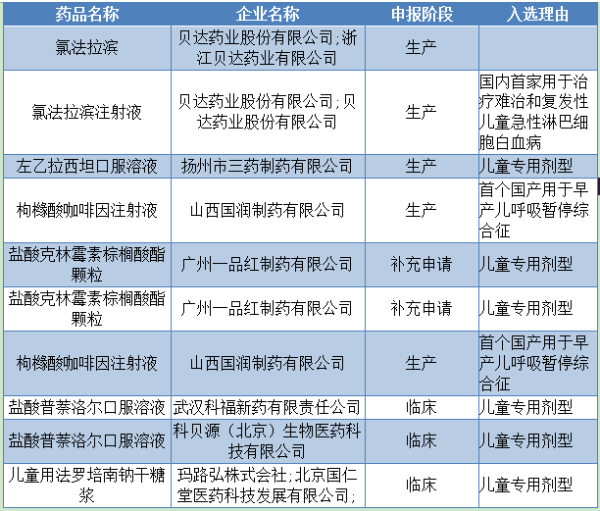
昨日,藥品審批審評中心發布了實行優先審評審批的兒童用藥注冊申請第一批名單以及優先審批的原則,有10個品種大大受益,可說是收割利好。
原因是在藥企紛紛撤回藥品注冊申請的時候,保留品種所剩無幾的情況下,這些品種的審批速度將會大大加快,其中還有四個申報生產的品種,更是值得重點關注。
優先審批條件寬
從國家局所列的優先審批的原則來看,規則是相當寬泛。,其他有相關品種品種也密切關注優先審批。
下面是兒童藥的優先獲批條件。
一是新藥申請:應滿足以下任一條件。
1、針對嚴重威脅兒童生命或者影響兒童生長發育,且目前無有效治療目前無有效治療藥物或治療手段疾病申請;
2、相比現有的治療手段,具明顯優勢申請。
二是改劑型或新增規格的申請:同時滿足以下兩個條件。
1、現有的藥品說明書中包含有確定的“兒童用法量” 的申請;
2、現行的劑型或規格均不適用于兒童, 新增的劑型或規格適合于兒童的申請。
三是仿制藥申請:
對于目前市場短缺的兒童用藥,實行優先審評。
仿制申報廠家的數目為多家申請的,按照申請先后排隊順序,按照申請先后排隊順序,對排第一位的優先審評,若經優先審評不符合要求,則取消優先資格,后面的同品種申請可按序增補替代。
其他7類有優先權的品類
預計國家藥審中心還會陸續公布其他類藥品有限審評名單,其他7類藥物也可以重點關注其中的重磅產品,其他7類藥品分別是:
1、防治艾滋病、惡性腫瘤、重大傳染病和罕見病等疾病的創新藥注冊申請;
2、兒童用藥注冊申請;
3、老年人特有和多發疾病用藥注冊申請;
4、列入國家科技重大專項和國家重點研發計劃的藥品注冊申請;
5、使用先進技術、創新治療手段、具有明顯治療優勢的臨床急需用藥注冊申請;
6、轉移到中國境內生產的創新藥注冊申請;
7、申請人在歐盟、美國同步申請并獲準開展藥物臨床試驗的新藥臨床試驗申請,或在中國境內用同一生產線生產并在歐盟、美國同步申請上市且已通過其藥品審批機構現場檢查的藥品注冊申請;
8、臨床急需且專利到期前3年的藥品臨床試驗申請和專利到期前1年的藥品生產申請。








